Des mains qui tremblent, des gestes figés, la marche qui ralentit. Pour beaucoup, la maladie de Parkinson évoque d’abord ces symptômes moteurs. Mais derrière cette apparence se cache une réalité complexe : une maladie neurodégénérative qui, en France, bouleverse la vie de près de 270 000 personnes.
Depuis des décennies, les traitements permettent de compenser la chute de la dopamine, sans jamais arrêter la progression. Aujourd’hui, un nouveau tournant s’esquisse. Les premiers résultats des greffes de cellules souches dans le cerveau donnent aux patients, aux chercheurs, aux familles, une perspective inédite : celle d’atténuer durablement les symptômes, voire de modifier le cours de la maladie.
Comprendre la maladie de Parkinson : bien plus que des tremblements
Découverte au début du XIXe siècle, Parkinson reste la deuxième maladie neurodégénérative au monde, derrière Alzheimer[1]. Elle touche principalement après 60 ans, mais frappe aussi des adultes plus jeunes. Sa cible : les neurones dopaminergiques de la substance noire du cerveau, essentiels au contrôle des mouvements. À mesure que ces cellules meurent, la dopamine chute. Les premiers signes, souvent discrets ou atypiques (fatigue, troubles digestifs, anxiété, perte de l’odorat), compliquent le diagnostic. Viennent ensuite les symptômes moteurs : tremblements, raideur, lenteur des mouvements, troubles de la marche.
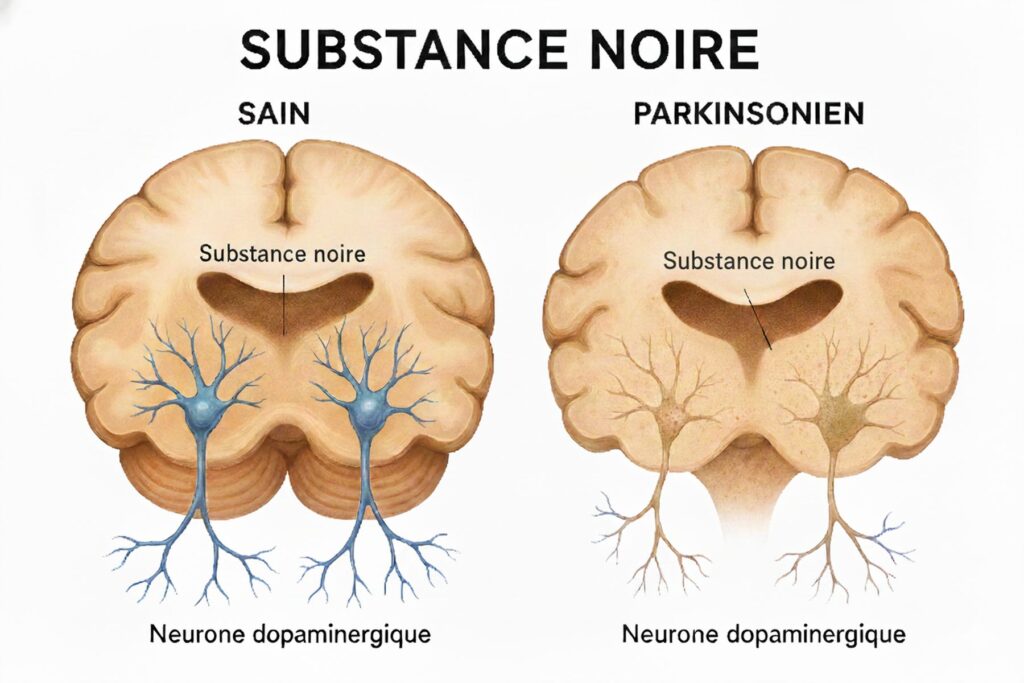
La maladie s’installe, évolue. Les médicaments, d’abord efficaces, perdent en puissance avec le temps. Les patients, leurs proches, les soignants, font face à une perte progressive d’autonomie, à un quotidien réaménagé en permanence.
LIRE AUSSI: Les 5 stades de la maladie de Parkinson
Cellules souches : une avancée décisive pour la médecine régénérative
Depuis plus de vingt-cinq ans, la recherche mondiale s’acharne à comprendre comment réparer le cerveau, pas seulement masquer les symptômes. Deux essais cliniques récents marquent un jalon. D’un côté, aux États-Unis, l’équipe de BlueRock Therapeutics (filiale de Bayer) transplante chez douze patients des cellules souches embryonnaires, transformées en progéniteurs neuronaux. De l’autre, au Japon, des chercheurs de Kyoto utilisent des cellules souches pluripotentes induites, dérivées des propres cellules des patients, pour éviter les enjeux éthiques.
Les résultats, publiés dans la revue Nature, bouleversent les attentes. Les cellules greffées survivent dans le cerveau, produisent de la dopamine, établissent des connexions fonctionnelles. Les troubles moteurs reculent nettement. Chez certains patients, l’amélioration atteint 50% après 18 mois, mesurée sur l’échelle UPDRS – un score de référence pour évaluer la gravité des symptômes. Au-delà de la mobilité, la qualité du sommeil, l’autonomie, la capacité à réaliser les gestes du quotidien s’améliorent.
Pourquoi cette avancée change la donne
Remplacer les neurones perdus, restaurer la production de dopamine au cœur du cerveau malade : cette approche semblait encore hors de portée il y a dix ans. La technologie a progressé à pas de géant. Cellules souches à prolifération quasi illimitée, protocoles de reprogrammation de cellules adultes, cryoconservation efficace, contrôles stricts de pureté et de sécurité… tout converge pour rendre la thérapie cellulaire possible à l’échelle clinique. L’un des protocoles a d’ailleurs obtenu le feu vert de la FDA américaine pour passer en phase 3, dernière étape avant une éventuelle généralisation.
La communauté scientifique parle d’un tournant pour Parkinson, mais aussi d’une nouvelle ère pour la médecine régénérative et les maladies neurodégénératives : Alzheimer, sclérose latérale amyotrophique, autres syndromes apparentés pourraient à terme bénéficier de ces avancées.
Des défis techniques et humains à relever
Nouveau souffle, certes, mais prudence. Passer de quelques patients à des milliers implique des défis : produire des cellules à grande échelle, garantir leur sécurité, organiser le transport et le stockage à l’international. Pour certains protocoles, l’immunosuppression reste nécessaire, afin d’éviter le rejet de la greffe. Le coût, enfin, pourrait restreindre l’accès à ces traitements dans un premier temps.
En parallèle, la dynamique de recherche s’intensifie. Conférences scientifiques, collaborations internationales, essais cliniques coordonnés entre centres hospitaliers, chercheurs et associations de patients. L’Institut du Cerveau à Paris, le CHU de Toulouse, l’université de Montréal, participent à cette course mondiale. Les patients, les familles, deviennent parties prenantes, acteurs de la recherche et de l’innovation.
Panorama des traitements actuels et innovations complémentaires
- Lévodopa : reste le traitement de référence depuis plus de 50 ans. Il compense la baisse de dopamine mais son efficacité s’amenuise au fil du temps.
- Médicaments dopaminergiques : souvent associés à la lévodopa, parfois à d’autres molécules, pour optimiser la gestion des symptômes moteurs.
- Stimulation cérébrale profonde : une électrode implantée dans le cerveau corrige certains troubles moteurs, technique de plus en plus affinée grâce à l’intelligence artificielle qui ajuste la stimulation en temps réel.
- Duodothérapie : une sonde délivre un gel-médicament directement dans l’intestin, assurant une diffusion régulière et stable de la dopamine, pour les formes avancées.
- Thérapie génique : insertion d’un gène dans le cerveau pour relancer la production naturelle de dopamine. Les essais se multiplient.
- Immunothérapie : les chercheurs développent des anticorps capables de neutraliser l’alpha-synucléine, protéine qui s’accumule dans le cerveau et accélère la dégénérescence.
- Approches sur le microbiote : le lien entre déséquilibres intestinaux et inflammation cérébrale est scruté de près. La transplantation fécale ou les probiotiques pourraient à terme moduler l’évolution de la maladie.
Vers une prise en charge personnalisée et globale
Les progrès ne se limitent pas au laboratoire. L’accompagnement des patients évolue. Médecins, physiothérapeutes, ergothérapeutes, orthophonistes, psychologues, travaillent en réseau. L’objectif : adapter le traitement à chaque profil, associer médicaments, activité physique, soutien psychologique, aménagement du quotidien. Les associations jouent un rôle clé, en informant, en soutenant, en militant pour l’accès à l’innovation.
Depuis peu, les outils d’imagerie de pointe et l’identification de biomarqueurs permettent de diagnostiquer plus tôt, d’individualiser les protocoles, de suivre précisément l’évolution. L’exploration des causes biologiques (inflammation, stress oxydatif, dysfonctionnements mitochondriaux) ouvre la voie à des traitements qui visent la cause, pas seulement les conséquences.
LIRE AUSSI: Parkinson et signes de fin de vie : durée et accompagnement
Questions fréquentes sur les avancées dans le traitement de Parkinson
Peut-on vraiment espérer une guérison grâce aux cellules souches?
Les essais cliniques montrent des améliorations significatives, mais la guérison totale reste pour l’instant hors de portée. L’objectif : transformer Parkinson en maladie chronique contrôlable.
Qui pourra bénéficier des greffes de cellules souches ?
Les premiers patients ciblés sont souvent à un stade avancé, avec une réponse insuffisante aux traitements classiques. L’accès dépendra des résultats des phases finales et des politiques de santé.
Quels risques avec ces thérapies innovantes ?
Le principal risque : le rejet de greffe, d’où la nécessité d’immunosuppresseurs dans certains cas. Les équipes surveillent aussi les risques de prolifération cellulaire non contrôlée ou d’effets secondaires neurologiques.
Les autres traitements vont-ils disparaître ?
Non, la stratégie reste d’associer plusieurs approches pour un bénéfice maximal, adapté à chaque patient.
Où trouver des informations fiables et du soutien ?
Les sites de l’Institut du Cerveau, France Parkinson, les centres hospitalo-universitaires spécialisés sont des ressources de référence.
Une décennie charnière pour Parkinson
Longtemps, la maladie de Parkinson a été synonyme de fatalité. Les avancées de la recherche, la mobilisation des patients, l’émergence de la thérapie cellulaire changent la perspective. Le pari d’aujourd’hui : transformer une maladie lentement destructrice en condition stabilisée, où l’autonomie, l’espoir, la qualité de vie reprennent toute leur place. Les prochains mois, les prochaines années seront décisifs ; l’optimisme prudent gagne du terrain dans les laboratoires comme chez les familles. Pour la première fois, l’horizon se dégage vraiment.
-
[1] Alzheimer
La maladie d’Alzheimer est une maladie qui affecte le cerveau, entraînant des pertes de mémoire et des difficultés à penser clairement, rendant progressivement les tâches quotidiennes plus difficiles.
Note de l’article (63 votes)
Cet article vous a-t-il été utile ?
Notez cet article afin de nous permettre d’améliorer nos contenus.
Réagissez, posez une question…











Peut – on espérer une solution avec la recherche actuelle pour un parkinsonien diagnostique depuis 7 ans ?
Bonjour
Je vous remercie pour votre commentaire.
La recherche actuelle progresse vers des traitements stabilisateurs (thérapies géniques, anticorps), mais ne permet pas aujourd’hui de garantir la guérison définitive.
Bonne journée.
Amandine
Exellent article
pourvue qu »il abouti a sont objectif